АВТОРЕФЕРАТ
На тему:
"САМОРАСПРОСТРАНЯЮЩЕЕСЯ ВЗАИМОДЕЙСТВИЕ СОЛЕЙ КАДМИЯ И МЕДИ С ПЕРОКСИДНЫМИ СОЕДИНЕНИЯМИ НАТРИЯ"
автор:
ШИБИКО М.М.
СОДЕРЖАНИЕ
1. Обоснование актуальности темы работы
2. Цель, задачи, научная новизна и практическая ценность работы
3. Обзор существующих исследований
4. Текущие и планируемые разработки по теме
5. Результаты исследований
Выводы
Список источников
1. ОБОСНОВАНИЕ АКТУАЛЬНОСТИ ТЕМЫ РАБОТЫ
Под самораспространяющимся взаимодействием (СРВ), или высокотемпературным синтезом (СВС), понимаются процессы, в которых освобождающаяся в результате самой химической реакции энергия вызывает саморазогрев вещества, что обеспечивает самостоятельное протекание превращений без подвода энергии извне. Самораспространяющееся взаимодействие, инициируемое вначале мощным тепловым источником, образует перемещающийся фронт реакций, который распространяется по всему объему твердофазной системы (образца) (рис.1) [1].

Рис.1 – Распространение фронта горения по твердофазному образцу
11 кадров, 6 повторений
Значение реакций горения, протекающих в режиме самораспространяющегося взаимодействия, для народного хозяйства очень велико. Эти реакции представляют собой значительный интерес для развития новых нетрадиционных методов синтеза неорганических соединений (например, оксидов из солей) и полезных газов (О2, Н2, N2, Cl2, F2, SO2, оксидов азота, оксидов хлора, а также СО, СО2 и др.). Обращает на себя внимание тот факт, что СРВ – самый перспективный способ получения кислорода, который позволяет устранить недостатки, имеющиеся в традиционных способах его получения. Использование процессов самораспространяющегося взаимодействия позволяет получать тугоплавкие неорганические соединения (карбиды, бориды, нитриды и т.д.), которые могут быть использованы для получения бескислородных огнеупоров и керамики. Эти процессы представляют собой интерес и для переработки токсичных отходов производства, позволяют получать вещества с необычной степенью окисления, например, с 3-х валентной медью. При этом нельзя не обратить внимание на неоспоримое преимущество процессов СРВ – они не требуют подвода энергии извне. Так как в результате таких реакций выделяется большое количество тепла, то их можно использовать как источники энергии (энергетические добавки) в любых смесях.
Однако, СРВ является одним из самых высокотемпературных процессов горения (температура горения составляет 2500 – 4000°С). Высокие температуры предопределяют большие скорости реакции. Из-за высоких скоростей и температур управление самораспространяющимся взаимодействием представляет собой достаточно сложную задачу, для решения которой необходимо иметь представление об особенностях осуществляемого процесса. А так как этот процесс является очень мало изученным, то поиск новых систем, способных реагировать в режиме СРВ, и изучение особенностей протекания такого рода реакций является актуальной задачей. Важно отметить, что для изучения СРВ большое значение имеют именно системы с солями или оксидами. Это объясняется тем, что в таких системах взаимодействие протекает при относительно невысоких температурах и скоростях, что делает их удобными моделями для изучения СРВ [2].
2. ЦЕЛЬ, ЗАДАЧИ, НАУЧНАЯ НОВИЗНА И ПРАКТИЧЕСКАЯ ЦЕННОСТЬ РАБОТЫ
Целью моей работы является изучение СРВ в системе CdSO4 – CuSO4 – NaO2 для определения особенностей протекания этого процесса в тройных системах и установления возможности получения в них тонкодисперсной смеси оксидов.
Достижение цели возможно при выполнении следующих задач:
1) установлении механизма процесса, протекающего в рассматриваемой системе при нагревании;
2) определении теплофизических и кинетических параметров взаимодействия и влияния на них различных факторов;
3) получении на практике смеси оксидов кадмия и меди, смешанных на молекулярном уровне.
Поскольку СРВ в тройных системах ранее никогда не изучалось (изучались только двойные системы), то система CdSO4 – CuSO4 – NaO2 была выбрана как наиболее простая модель для его изучения, так как в ней не предполагается взаимодействие продуктов реакций с исходными компонентами и между собой. В силу того, что проводимая работа является первой работой, посвященной изучению СРВ в тройных системах, можно говорить о ее научной новизне, которая состоит в дальнейшем развитии нового направления – химии самораспространяющихся реакций на основе неорганических пероксидно–солевых систем.
Предполагается, что результаты работы могут быть использованы в следующих направлениях. Во-первых, они важны для понимания в целом особенностей СРВ в тройных системах (будет установлено, существует ли взаимное влияние солей друг на друга, каким образом это сказывается на механизме и параметрах процесса и т.д.). Кроме того, результаты исследования системы CdSO4 – CuSO4 – NaO2 частично могут быть перенесены на тройные системы с другими солями. Например, получение в лабораторных условиях смеси оксидов кадмия и меди, смешанных на молекулярном уровне, подтвердит возможность получения таких смесей самораспространяющимся взаимодействием в любых тройных системах. Такой вывод является очень важным с практической точки зрения, потому что он указывает на возможность получения с помощью СРВ пьезокерамических материалов (при использовании систем, в которых образуются оксиды, проявляющие пьезоэлектрические свойства) и ферритов (при использовании систем, образующих один из оксидов Fe2O3, а второй – отвечающий формуле МеО). Получение смеси оксидов самораспространяющимся взаимодействием позволило бы добиться наиболее полного и равномерного их смешения на молекулярном уровне, что является важным для производства пьезокерамики и чего практически невозможно достичь при традиционных способах ее получения. Кроме того, получение пьезокерамических материалов и ферритов с помощью СРВ является экологически чистым (не образуются сточные воды), быстрым и дешевым способом.
Во-вторых, результаты работы могут быть полезными для переработки токсичных отходов производства путем перевода самораспространяющимся взаимодействием растворимых солей (CdSO4, CuSO4) в нерастворимые оксиды (CdO, CuO), которые благодаря своей нерастворимости не оказывают вредного воздействия на окружающую среду. Во время выпадения осадков они не растворяются и не проникают в почву [3].
3. ОБЗОР СУЩЕСТВУЮЩИХ ИССЛЕДОВАНИЙ
Работы в области изучения процесса горения начались не так давно. В 30-е годы ХХ века были заложены основы теории горения в фундаментальных исследованиях Н.Н.Семенова, Я.Б.Зельдовича и Д.А.Франк-Каменецкого. Однако, значительно раньше человек научился применять горение на практике. В области практического использования процесса горения можно выделить два очень важных направления:
1) энергетическое;
2) химико-технологическое.
В энергетическом направлении процесс горения используют с целью получения тепла, в химико-технологическом – с целью получения продуктов горения. Энергетическое направление получило широкое развитие, и теория горения была создана на основе изучения именно энергетического горения. Практически все задачи в теории горения были стимулированы проблемами исследования химической энергии. В свою очередь, специалисты в области теории горения внесли серьезный вклад в энергетику. Общими усилиями ученых и конструкторов были развиты такие области, как моторостроение, теплоэнергетика, ракетная техника.
Что касается химико-технологического направления, то оно развивалось в отрыве от теории горения, в основном, химиками-технологами и металлургами и свелось к разработке отдельных процессов. К сожалению, объем и уровень исследований здесь недостаточно высоки и не соответствуют большому значению этой проблемы для народного хозяйства. СРВ, позволяющее синтезировать тугоплавкие неорганические соединения, – самый малоизученный процесс технологического горения. Работы в этой области начались в 1967 году после того, как академиком Мержановым А.Г. было обнаружено явление распространения фронта горения в смесях порошков тугоплавких химических элементов, приводящее к образованию тугоплавких соединений. Это новое и совсем малоисследованное направление, в котором в основном изучались системы простых веществ, например, Ta-N, Zr-N (для получения нитридов); Ni-Al, Zr-Al, Mo-Al, Fe-Al (для получения алюминидов); Nb-С, Ta-C (для получения карбидов); Mo-B, Cr-B (для получения боридов) и др. Реакции в таких системах представляют собой сильно экзотермическое взаимодействие химических элементов в конденсированной фазе, протекающее в режиме горения [2].
Группой ученых под руководством А.Г.Мержанова предложена методика термодинамического расчета адиабатических температур СРВ-реакций для случая полного превращения реагентов в зоне горения. Проведены конкретные расчеты для реакции синтеза боридов металлов IV-VI групп, образования карбидов и силицидов. Установлена связь между температурой горения и положением реагирующих компонентов в периодической системе элементов, пределы горения смесей, корреляция между температурами и скоростями горения.
Струниной А.Г., Демидовой Л.К., Бутаковой Э.А., Барзыкиным В.В. экспериментально изучались закономерности горения малогазовых систем.
Имеются работы, посвященные математическому моделированию процессов СРВ. Так, Шкадинским К.Г., Струниной А.Г., Фирсовым А.Н., Демидовой Л.К. и Костиным С.В. построена физико-математическая модель горения пористой смесевой системы, способной к фронтальному реагированию. Вопросами моделирования таких систем занимались Берман В.С., Рязанцев Ю.С., Любченко И.С. и др.
Анализ литературных источников свидетельствует о том, что в последнее время на базе СВС развиваются различные комбинированные процессы. Примером могут служить работы Бурова Ю.М., Григорьева Ю.М., Давыдовой Г.И, Чуканова Н.В., посвященные развитию комбинированных процессов, представляющих собой сочетание СВС и металлотермии. Сущность таких процессов состоит в том, что металл, являющийся одним из реагентов в СВС-процессе, образуется в результате металлотермической реакции, которая предшествует СВС. Некоторые работы школы Мержанова посвящены разработке технологических процессов получения в режиме СВС металлокерамических материалов, а использование СВС в методах наплавки защитных покрытий на поверхность стальных изделий рассматривается в работах Тараканова А.Ю., Ширяева А.А., Юхвида В.И. Имеются данные о развитии подобных процессов и за рубежом [1].
Выводы о существующей в настоящее время тенденции развития комбинированных процессов можно сделать и на основании результатов поиска в Интернет материалов по теме работы. Научно-исследовательские институты и некоторые вузы России предлагают проекты по использованию процессов СРВ в машиностроении, металлургии, энергетике, производстве огнеупоров, теплоизоляционных материалов, аккумуляторов и т.д. Очень интересно предложение утилизации методом СРВ карбида кальция, являющегося отходом производства ацетилена, и создания на его основе эффективного сорбента гербицидов [4], а также предложение создания промышленной линии переработки нефтешламов и изготовления на ней методом СРВ строительных материалов [5].
Но несмотря на то, что проводится достаточно много работ по исследованию экзотермических химических реакций, протекающих в режиме СВС, достаточно детально изучены процессы, как правило, для смесей порошков тугоплавких химических элементов (синтез боридов, карбидов, силицидов, нитридов) [1].
Однако, в последние годы большой практический интерес вызвали и системы из соединений, например, системы с солями или оксидами, в которых взаимодействие протекает с небольшим выделением тепла и которые совсем мало изучены. Интерес к этому направлению заключается, во-первых, в том, что использование более дешевого сырья, чем порошков металлов, снижает стоимость тугоплавких соединений и, во-вторых, применение летучих компонентов (например, хлоридов) позволяет осуществлять процесс горения в газовой фазе и получать целевые продукты в виде порошков с высокой удельной поверхностью, что важно для некоторых применений [2].
Немногочисленые работы по исследованию таких систем проводили В.Я.Росоловский, З.К.Никитина, С.М.Синельников (Институт новых химических проблем РАН, г.Черноголовка), изучавшие СРВ пероксидных соединений натрия с хлоратами и перхлоратами некоторых металлов (лития, кальция, кадмия, цинка, марганца, кобальта, никеля), а также преподаватели нашего университета: В.В.Шаповалов, А.Н.Гороховский, Ю.В.Мнускина, в работах которых изучено самораспространяющееся взаимодействие в системах с сульфатами металлов (кадмия, меди, никеля, железа, алюминия, свинца, марганца и магния), с нитратом кадмия и хлоридом меди (I). Профессором ДонНТУ Шаповаловым В.В. разработана методика определения кинетических параметров самораспространяющегося взаимодействия [6], а доцентом Гороховским А.Н. разработаны программы, позволяющие рассчитывать эти параметры в пероксидно-солевых системах с помощью ЭВМ.
В результате поиска в Интернет не было найдено ни одного информационного источника о самораспространяющемся взаимодействии в пероксидно-солевых системах, за исключением электронной библиотеки магистрантки ДонНТУ 2004г. Касьянчук О.А. Все это указывает на очень малый объем исследований, проводимых в данной области. Поэтому, остается большое количество систем, которые еще не исследовались, и широкое поле для дальнейшей деятельности в этом направлении. В силу выше сказанного, основные проблемы, существующие сейчас в данной области, можно свести к следующим двум:
1) недостаточный уровень исследований и объем знаний о процессах, протекающих в режиме СРВ;
2) неумение управлять этими процессами и контролировать их.
4. ТЕКУЩИЕ И ПЛАНИРУЕМЫЕ РАЗРАБОТКИ ПО ТЕМЕ
В работе по изучению системы CdSO4 – CuSO4 – NaO2 в настоящее время проводится дифференциально-термический ее анализ (ДТА) при различных соотношениях исходных компонентов в реакционной смеси. Схема установки для термического анализа приведена на рис.2.
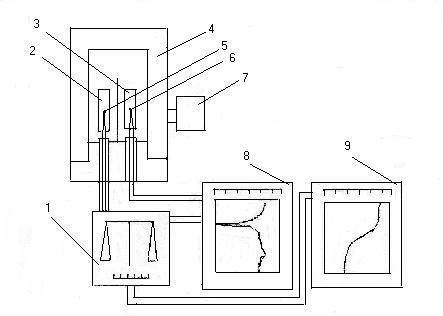
Рис.2 – Схема установки термического анализа:
1 – весы;
2 – образец;
3 – эталон;
4 – печь;
5 – термопара интегральная;
6 – термопара дифференциальная;
7 – регулятор температуры;
8 – самописец ДТА;
9 – самописец ТГ.
В установке применяются калиброванные хромель-алюмелевые термопары. Основным рабочим узлом установки для регистрации кривых ДТА является стандартная печь пирометра Н.С. Курнакова, которая по направляющим опускается на тигли с исследуемым образцом и эталоном. В дне каждого из тиглей, изготовленных из термостойкого стекла, предусмотрены углубления для ввода термопар. Термопары (интегральная для измерения температуры образца и дифференциальная для измерения разности температур образца и эталона) заключены в керамические трубки. Керамическая трубка с термопарой для эталона запрессована в специальный экранирующий блок и выступает из него на 12-15 см. Керамическая трубка с термопарой для исследуемого образца проходит через отверстие в специальном экранирующем блоке и связана с коромыслом аналитических весов. Температурный режим регулируется электронной системой, состоящей из высокоточного регулятора температуры ВРТ-3. Для записи кривых ДТА используются двухкоординатные самописцы типа Н 307. Скорость нагревания составляет 14°С/мин. Термический анализ проводится в тиглях из стекла. Образцы для анализа готовятся путем смешения порошкообразных реагентов. При измерениях в качестве эталона используется а–Al2O3.
Термические методы анализа, к числу которых относится ДТА, являются одними из основных при исследовании процессов в конденсированных системах. Экспериментально получаемые кривые ДТА используются для получения первичной информации о температурном интервале взаимодействия веществ, температуре начала заметного взаимодействия и наиболее интенсивного взаимодействия, а также фазовых превращениях исходных и образующихся веществ. В нашем случае использование ДТА должно экспериментально подтвердить или опровергнуть рассчитанную с помощью ЭВМ температуру интенсивного взаимодействия в системе.
Установление точной температуры взаимодействия позволит (зная величину скорости распространения фронта горения в системе) с помощью специальной программы определить кинетические параметры процесса СРВ (энергию активации и предэкспоненциальный множитель). Зная точную температуру взаимодействия в системе и скорость горения в ней, с помощью этой программы можно подобрать кинетические параметры процесса, при которых будет наблюдаться совпадение расчетных и экспериментальных значений температуры и скорости. Именно эти значения кинетических параметров и можно считать наиболее вероятными. Поэтому для определения эффективных кинетических параметров СРВ необходимо совместное использование данных ДТА и скорости распространения фронта СРВ [6].
Кроме того, сопоставление кривых ДТА, полученных при исследовании системы с различным соотношением в ней исходных компонентов, позволит сделать предварительные выводы о направлениях протекания в ней процесса при недостатке или избытке того или другого компонента. На основании этих выводов можно будет судить о механизме самораспространяющегося взаимодействия в изучаемой системе.
Подтвердить сделанные предположения можно с помощью рентгенофазового анализа смеси продуктов СРВ, который также запланирован на будущее. Рентгенофазовый анализ смесей продуктов (образующихся в системе при различном соотношении исходных реагентов) должен быть проведен с целью идентификации веществ, находящихся в этих смесях. По идентифицированным продуктам взаимодействия можно сделать окончательный вывод о механизме процесса, протекающего в рассматриваемой системе.
Кроме рентгенофазового анализа, для максимально точного определения механизма СРВ в системе намечено и проведение спектрального анализа смеси продуктов взаимодействия, который по характерным полосам поглощения инфракрасных излучений позволяет идентифицировать находящиеся в этой смеси вещества.
С целью определения соотношения скоростей параллельно идущих реакций взаимодействия сульфата меди с Na2O2 и сульфата кадмия с Na2O2 планируется провести полярографический анализ определения непрореагировавшего CdSO4 в смеси продуктов при недостаточном содержании в исходной реакционной смеси супероксида натрия (данные по определению остаточного CuSO4 уже имеются).
5. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
На сегодняшний день в процессе исследования системы CdSO4 – CuSO4 – NaO2 получены следующие результаты.
1. Составлено математическое описание процессов, протекающих в рассматриваемой системе при нагревании, основанное на предположении, что в системе протекают следующие реакции:
| NaО2 = v1 Na2O2 + v2 O2 | (1) |
| Na2O2 + v3 СuSO4 = v4 Na2SO4 + v5 СuО + v6 O2, | (2) |
| Na2O2 + v7CdSO4 = v8 Na2SO4 + v9 CdO + v10 O2, | (3) |
где v1 – v9 – массовые стехиометрические коэффициенты, показывающие, что все расчеты проводятся на 1кг супероксида натрия.
Считая, что побочные реакции в данной системе отсутствуют, математическое описание процессов, протекающих в системе, представляет собой систему следующих дифференциальных уравнений:
| Для NaО2: | dm1/dt = -m01 * k1 * exp(-E1/RT) * f1(a), |
| Для СuSO4: | dm2/dt = -m02 * k2 * exp(-E2/RT) * m4 * f2(a), |
| Для CdSO4: | dm3/dt = -m03 * k3 * exp(-E3/RT) * m4 * f3(a), |
| Для Na2O2: | dm4/dt = -v1 * (dm1/dt) + (dm2/dt) / v3 + (dm3/dt) / v7, |
| Для O2: | dm5/dt = -v2 * (dm1/dt) - v6/v3 * (dm2/dt) - v10/v7 * (dm3/dt), |
| Для Na2SO4: | dm6/dt = -v4/v3 * (dm2/dt) - v8/v7 * (dm3/dt), |
| Для CuО: | dm7/dt = -v5/v3 *(dm2/dt), |
| Для CdО: | dm8/dt = -v9/v7 * (dm3/dt), |
где m1 – m8 – текущие массовые доли NaО2, CuSO4, CdSO4, Na2O2, O2, Na2SO4, CuО, CdО;
m01, m02 и m03 – исходные массовые доли NaО2, CuSO4 и CdSO4 соответственно;
k1, k2 и k3 – предэкспоненциальные множители соответствующих реакций;
Е1, Е2 и Е3 – энергии активации соответствующих реакций;
f(a) – кинетическая функция;
t – время;
Т – температура;
2. Рассчитаны основные теплофизические характеристики изучаемой системы, которые составляют:
1) тепловой эффект реакции разложения NaO2 – +10.09 кДж/моль;
тепловой эффект реакции взаимодействия CuSO4 с Na2O2 – -265.10 кДж/моль;
тепловой эффект реакции взаимодействия CdSO4 с Na2O2 – -198.58 кДж/моль;
2) адиабатическая температура, развиваемая в системе, – +1067.7 К;
3) мольная теплоемкость системы – 0.58 кДж/моль.
3. В результате теоретического расчета системы, проведенном с помощью ЭВМ, определены: температура интенсивного взаимодействия, составившая 230°С, и величина пика экзотермического эффекта – 127°С. Получена картина распределения концентраций реагирующих веществ и продуктов во фронте горения (рис.3).
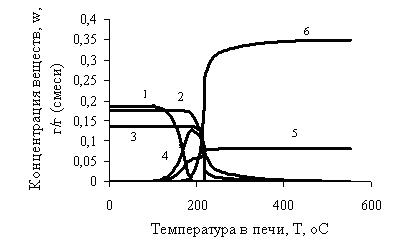
Рис.3 – Распределение концентраций во фронте горения:
1 – концентрация NaO2;
2 – концентрация CdSO4;
3 – концентрация CuSO4;
4 – концентрация Na2O2;
5 – концентрация O2;
6 – концентрация Na2SO4.
4. Кроме теоретических расчетов, было проведено экспериментальное определение скорости горения в системе, которая составила 83.54 мм/мин. Скорость определялась на таблетке, спрессованной из стехиометрической смеси реагентов. Исходными реагентами служили безводные CuSO4, CdSO4 и NaO2. Супероксид натрия использовали без предварительной подготовки. Сульфаты предварительно были высушены под вакуумом. Скорость определялась как отношение высоты таблетки ко времени ее полного сгорания.
5. Также в процессе исследования системы было проведено йодометрическое определение количества непрореагировавшего сульфата меди при недостатке в системе супероксида натрия. Для этого смесь продуктов, оставшаяся после проведения ДТА системы, была растворена в 100 мл воды. Затем раствор был отфильтрован, и к фильтрату добавлено рассчитанное количество йодида калия и несколько капель крахмала. После этого раствор титровался тиосульфатом натрия. По результатам йодометрического определения количество CuSO4 составило в среднем 6.8% от массы всей смеси продуктов [3].
ВЫВОДЫ
В литературных источниках и в Интернет нет данных об изучении СРВ в тройных системах. Это позволяет сделать вывод о том, что такие системы до сих пор не изучались. Но учитывая, что они представляют собой значительный практический интерес, работы по изучению СРВ в тройных системах должны быть проведены.
Так как на сегодняшний день выполнена лишь небольшая часть работы в этом направлении, и математическое описание процессов в изучаемой системе основано лишь на предположениях, то по имеющимся результатам еще преждевременно делать какие-либо выводы.
СПИСОК ИСТОЧНИКОВ
1. Гороховский А.Н. Самораспространяющееся взаимодействие супероксида и пероксида натрия с сульфатами некоторых s-, p-, d- металлов : Дис...канд. хим. наук : 02.00.01. – Д., 2000. – с.24
2. Процессы горения в химической технологии и металлургии /Под ред. Мержанова А.Г. Ред.- изд.отдел ОИХФ АН СССР. г.Черноголовка. 1975г. – 289с.
3. Шибико М.М., Шаповалов В.В., Мнускина Ю.В. Самораспространяющееся взаимодействие сульфатов меди и кадмия с супероксидом натрия. Конференция ДонНТУ, 2006г.
4. Климентьева Ю.И., Воробьева Ю.А., Стешенко О.Н. Получение углеродсодержащих сорбентов из отходов карбида кальция в режиме СВС. – http://pyrotechnics.narod.ru/tez/ilip2001/02.tml.
5. Владимиров В.С., Корсун Д.С., Карпухин И.А., Мойзис С.Е. Технологии: "Переработка и утилизация нефтешламов резервуарного типа". – http://www.smb-support.org/bp/arhiv/4/tech.htm.
6. Шаповалов В.В. Определение кинетических параметров интенсивных экзотермических твердофазных реакций //Укр.хим.журнал. – 2000. – Т.66. – №7. – с.31 – 36.